
 bioiod@bioiod.ru
bioiod@bioiod.ru Обратная связь
Обратная связь1ГУ НИИ Питания РАМН, Устьинский пр., д. 2/14, Москва, 109240, Россия.
2ООО «НПФ Техновита», ул. Ленина, 73, Боровск, Калужская обл., 249010, Россия.
1Institute of Nutrition RAMS, Ust, insky Proezd Str. 2/14, Moscow, 109240, Russia.
2OOO «SPF Technovita», Lenina Str. 73, Borovsk, Kaluga Region, 249010, Russia.
Биологические свойства йода многообразны. Йод обладает антивирусной и антибактериальной активностью, которая представляет важнейшую характеристику лекарственного антисептического препарата. Однако одним из самых важных проявлений биологической активности йода является функция его как микробиоэлемента, участвующего в синтезе жизненно необходимого гормона щитовидной железы. Биологическая роль йода заключается в обеспечении нормального состояния и функционирования щитовидной железы.
В ходе длительной эволюции наземных организмов их внутренняя среда претерпела количественные и качественные изменения по сравнению с колыбелью жизни — водой Мирового океана. Интересны следующие факты. Среднее содержание йода в океанской воде составляет 0,000005 %, а в плазме крови человека — 0,00001 %, то есть содержание йода во внутренней среде человека не только не снизилось, а наоборот, сохранилось на уровне вдвое большем, чем в воде океана. Таким образом, человек является видом — концентратором йода. Этот факт подчеркивает ту уникальную роль, которую играет йод в жизнедеятельности человеческого организма (Мохнач, 1974; Braverman, 1994; Панасин и др., 2002).
Свойства йода были хорошо известны людям за тысячи лет до то го, как был открыт этот химический элемент. 1854 г. француз Шатен обнаружил прямую зависимость между заболеваниями щитовидной железы и количеством йода в воздухе, пище и воде. В 1896 г. Бауман обнаружил поразительно большое количество йода в ткани щитовидной железы и установил, что этот специфический микроэлемент концентрируется в этом органе (Мохнач, 1974).
Деятельность щитовидной железы долгое время была не изучена, ей отводилась почти мистическая роль. В древности ее считали местом, куда поселяется душа, а округлую, чуть припухлую шею — признаком женской привлекательности. В настоящее время неоспоримым является факт, что щитовидная железа является органом внутренней секреции, реализующим биологическую функцию йода (Ковальский, 1972; Балаболкин, 1989).
Щитовидная железа расположена на передней поверхности шеи, состоит из двух продолговатых долей и перешейка. Особое биологическое значение йода заключается в том, что он является составной частью молекул гормонов щитовидной железы: тироксина (Т4) и трийодтиронина (ТЗ) (рис. 1). Способность концентрировать в тканях йод не уникальна для щитовидной железы. Ряд других тканей в организме также способны накапливать йод. Это слюнные железы и некоторые железы желудка, плацента, молочная железа (концентрация йодида может превышать концентрацию в сыворотке крови в 20-60 раз) (Балаболкин, 1989; Braverman, 1994).
Структурными единицами щитовидной железы является фолликулы, которые окружены соединительнотканными перегородками. Фолликулы густо оплетены кровеносными сосудами и интенсивно снабжаются кровью. Стенка фолликула представляет собой один слой тиреоцитов, обращённых апикальными концами в полость фолликула, которая заполнена коллоидом. Щитовидная железа получает иннервацию от симпатической и парасимпатической систем.
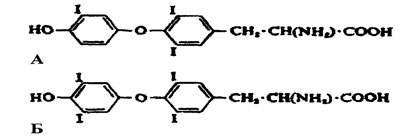
Рис. I. Гормоны щитовидной железы. А — трийодтиронин (ТЗ); Б— тироксин (Т4).
Щитовидная железа, несмотря на малые размеры и массу, за счет вырабатываемых гормонов влияет на организм по многим направлениям, обеспечивая нормальное функционирование большинства органов и систем. Причем это воздействие четко взаимосвязано с другими эндокринными железами — надпочечниками, половыми железами, гипофизом, нервной и иммунной системами. Это позволяет организму адекватно реагировать на постоянно изменяющиеся условия внешней и внутренней среды (Балаболкин, 1989; Марри и др., 1993; Braverman, 1994; Велданова, Скальный, 2001).
Йод поступает в организм с пищей и водой в виде неорганических соединений — йодидов и йодатов, так и в составе органических веществ, йодированных аминокислот. Неорганические соединения йода положительных степеней окисления, в частности йодаты, при попадании в кишечник восстанавливаются до йодидов. Попавшие в ток крови йодиды всасываются в верхнем отделе тонкого кишечника и через кровеносную систему попадают в щитовидную железу и почки, последние осуществляют выведение йода из организма. Таким образом, при поступлении в организм йода в виде йодидов часть этого микроэлемента не достигает щитовидной железы (Braverman, 1994; Buchingeretal., 1997; Велданова, Скальный, 2001).
Для нормального функционирования щитовидной железы суточное поступление йода должно составлять 150—200 мкг. В норме щитовидная железа аккумулирует примерно 15-20 % поступающего в организм йода, остальное его количество выводится с мочой (Герасимов и др., 2002). Показано, что при высокой физической нагрузке йод может выделяться из организма с потом (Suzuki, Tamura, 1985). Однако при недостаточном поступлении йода или повышенной функциональной активности щитовидной железы она поглощает гораздо больший процент этого элемента. Соотношение количества йода, поступающего в щитовидную железу и экскретируемого с мочой почками, зависит от функционального состояния железы и количества поступающего с пищей и водой йода (Мохнач, 1974; Школьник, 1974; Балаболкин, 1988; Марри и др., 1993).
Тиреоидный эпителий обладает свойством активно накапливать йодиды против градиента концентраций. С помощью активного процесса («йодидного насоса»), фолликулярные клетки накапливают йодид против химического и электрического градиентов: внутриклеточная концентрация этого иона обычно в 25-50 раз превышает его концентрацию в плазме крови. Этот процесс называют «захватом йода». Накопление йодидов против высокого электрохимического градиента, связанное с затратой энергии, осуществляется за счет АТФ-зависимого Nа+/К+-насоса. Некоторые сердечные гликозиды, угнетающие активность АТФ-фазы щитовидной и поджелудочной желез, угнетают и транспорт йодида в щитовидную железу (Балаболкин, 1988; Марри и др., 1993; Dai et al., 1996).
Перенос йодида, вероятно, осуществляется ещё не идентифицированным белком, доказательством чего может служить тот факт, что процесс захвата и транспорта йодидов находится под генетическим контролем (Кандрор, 2001). Небольшое количество йодида также может поступать в щитовидную железу путём диффузии, а внутриклеточный йод, не включённый в стабилизирующие соединения (около 10 %), может этим же путём покидать железу.
Активность механизма концентрирования йодида в ткани щитовидной железы можно характеризовать отношением его количества в щитовидной железе к йодиду сыворотки. Эта величина регулируется тиреотропином. Транспортный механизм концентрации йода ингибируется несколькими классами молекул. Первая группа состоит из анионов: перхлорат- (ClO4-), перренат- (ReO4-) и пертехнетат-(TcO4-). Эти анионы конкурируют с йодидом за белок-переносчик и концентрируются щитовидной железой. Молекулы второй группы, например тиоцианат- (SCN-) конкурентно тормозят транспорт I-, но не накапливаются в щитовидной железе. Кроме указанных веществ, ингибирующий эффект на транспорт йода в щитовидную железу могут проявлять ингибиторы аэробного дыхания (цианид, азид, арсенит), соединения, реагирующие с сульфгидрильными группами, ионы меди, ртути, бромацетат, 2,3-димеркаптоимидазол, а также разобщители окислительного фосфорилирования (2,4-динитрофенол, сердечные гликозиды) (De Groot et al., 1996; Wier-singa, Krenning, 1998; Dunn, Dunn, 2000).
Поступивший в щитовидную железу йод (в основном в виде йодида) включается в состав белков щитовидной железы и в том числе в основной белок щитовидной железы — тиреоглобулин — «органифицируется» (Hunt, 1984). Органификация необходима для связывания и удержания йода, т.к. он в таком виде уже не может покинуть железу.
Тиреоглобулин (молекулярная масса 660 кДа) содержит 115 остатков тирозина, которые потенциально могут вступать во взаимодействие с йодом. В ходе реакции I- переводится в I+, который затем замещает атом водорода в 3 и 5 положениях в тирозине. В первую очередь происходит замещение в третьем положении ароматического кольца (с образованием монойодтирозина МИТ), затем в пятом, с образованием дийодтирозина (ДИТ). Это включение йода — йодирование — катализируется тиреоидной пероксидазой (ТПО), которая представляет собой мембранно-связанный ферментный комплекс, простатическую группу которого образует гем. Йодирование сопровождается образованием энзим-ассоциированного промежуточного соединения (ТПО-Ioxid,) и последующего алкилирования акцептора, каким является свободный тирозин или тирозин, входящий в состав белков щитовидной железы (Hunt, 1984; Josern et al., 1984). Прежде чем произойдет такое йодирование (то есть процесс «органификации йода»), должна образоваться перекись водорода. По всей вероятности, она продуцируется НАД*Н-цитохром-В- или НАДФ*Н-цитохром-С-редуктазой.. На этот процесс влияет природа рядом расположенных аминокислот, а также третичная конформация тиреоглобулина.
Считается, что в процессе органификации йода участвуют глутатион, цистеин, аскорбиновая кислота. Как правило, ДИТ образуется больше, чем МИТ, а небольшая часть йода (около 10 %) вообще не связывается и легко покидает железу (Балаболкин, 1989; Volpe, 1989; Sugawara et al., 1990). Ряд соединений способны (через угнетение пероксидазы) ингибировать окисление йода и его дальнейшее включение в МИТ и ДИТ. Среди них наиболее важны соединения тиомочевины (тиоурацил, метимазол, пропилтиоурацил), которые применяются в качестве антитиреоидных препаратов, способных подавлять синтез гормонов на этом этапе (Hunt, 1984; Nametz, 1984 Gaitan, 1990).
Следующим этапом синтеза гормонов щитовидной железы является конденсация йодтирозинов. Конденсация двух молекул ДИТ с образованием тироксина Т4 или молекул МИТ и ДИТ с образованием ТЗ происходит в составе молекулы тиреоглобулина, хотя потенциально возможна и конденсация свободных МИТ и ДИТ со связанными ДИТ. В настоящее время получены убедительные данные, позволяющие считать, что процесс конденсации осуществляется в три этапа под влиянием тиреопе-роксидазы. Сначала йодтирозины окисляются с помощью этого фермента в активную форму. Активированные таким образом йодтирозиновые остатки внутри той же молекулы тиреоглобулина превращаются в интермедиатные квинольные эфиры. Последние через конверсию боковой цепи аланина до дегидроаланина образуют тиронины (Hunt, 1984; Josern etal., 1984).
Тиреоглобулин обладает, по-видимому, уникальной третичной структурой, способствующей конденсации йодтирозиновых остатков. Действительно, содержание тирозина в этом белке мало отличается от такового в других белках и йодирование тирозиновых остатков может происходить в любом из них. Однако реакция конденсации осуществляется с достаточно высокой эффективностью, вероятно, только в тиреоглобулине.
Процесс йодирования тиреоглобулина и синтеза гормонов происходит у апикальных микроворсинок тиреоцитов, обращённых в просвет фолликула.
Йодированный таким образом тиреоглобулин секретируется в полость фолликула, где и хранится в составе коллоида «про запас», и лишь небольшая его часть поступает в кровоток Большая часть фолликулов щитовидной железы предназначена для хранения тиреоглобулина, и количество в нем тиреоидных гормонов таково, что если полностью блокировать биосинтез тиреоидных гормонов, то запасов ТЗ и Т4 будет вполне достаточно для поддержания эутиреоидного состояния в течение месяца. Таким образом, тиреоглобулин, главный компонент коллоида, выполняет функции матрицы для синтеза тиреоидных гормонов и их депонирования.
Щитовидная железа синтезирует и секретирует в кровь ТЗ и Т4, но в большей степени тироксин (Т4). Средние концентрации ТЗ и Т4 в тиреоидной ткани составляют примерно 0,02 и 0,3 мкмоль/г (15 и 200 мкг/г), соответственно, тогда как в плазме концентрация Т4 колеблется от 5 до 11 мкг% (64,3— 141 мМ), а ТЗ — от 80 до 180 нг% (1,27-2,76 мМ) (Drexhage, 1994; De Groot et al., 1996; Герасимов и др., 2002).
Высокое содержание общего Т4 и/или ТЗ может наблюдаться при синдроме повышенного содержания тироксинсвязывающих белков, а повышение содержания свободных фракций этих гормонов — при нарушении синтеза этих белков, в частности, при патологии печени.
Низкий уровень Т4 и ТЗ может наблюдаться в пожилом возрасте, при атеросклерозе, заболеваниях почек, сердца, психики; приеме препаратов йода, брома (Volpe, 1989; De Groot et al., 1996). Наряду с тиреоидными гормонами в результате протеолиза тиреоглобулина отделяются также молекулы негормональных йодированных аминокислот монойодтирозина и дийодтирозина. Они дейодируются в тиреоидных клетках, а освободившийся йод вновь включается в описанный выше цикл. Повторная утилизация йода представляет собой важный механизм его сохранения.
Попав в кровь тиреоидные гормоны (ТЗ и Т4), разносятся по организму в связанном виде с белками плазмы — тироксинсвязывающим альфа-глобулином, преальбумином и альбумином. Роль белков-переносчиков в процессах транспорта тиреоидных гормонов заключается в предупреждении потери гормонов через почки и печень и регуляции скорости их доставки на периферию.
Тироксинсвязывающий альфа-глобулин связывает и транспортирует 75 % тироксина и 85 % трийодтиронина. Период его полураспада 5 дней и скорость разрушения 15 мг/сут. Тироксинсвязывающий альфа-глобулин более прочно связывает тироксин, в то время как связь с трийодтиронином в 4-5 раз слабее по сравнению с Т4.
Период полураспада преальбумина составляет 2 дня и скорость разрушения 650 мг/сут. Этот белок связывает около 10-15 % Т4 и менее 5 % ТЗ. Прочность связи преальбумина с тироксином значительно уступает связи тироксинсвязывающего альфа-глобулина с Т4. Связь же преальбумина с ТЗ очень слабая и его способность связывать ТЗ в 10 раз ниже по сравнению с Т4.
В связи с высокой концентрацией альбумина в сыворотке крови он обладает большой связывающей способностью и переносит около 10 % Т4 и несколько меньше ТЗ. Его связь с тиреоидными гормонами наименее прочная из всех трех белков-транспортеров тиреоидных гормонов. Поэтому он является основным источником свободных тиреоидных гормонов на периферии (Dick, Watson, 1981; Марри и др., 1993; Braverman, 1994; Балаболкин, 1998).
Роль белков, связывающих тиреоидные гормоны, в организме велика. Они связывают избыточное количество этих гормонов, ограничивая в строгих пределах фракцию свободных гормонов, и тем самым, с одной стороны, предупреждают потерю их через выделительную систему (печень и почки), а с другой стороны — регулируют скорость доставки тиреоидных гормонов на периферию, где они оказывают основное метаболическое действие. Вместе с этим, наличие разных видов тироксинсвязывающих белков обеспечивает наиболее прочный комплекс белка с ТЗ и Т4 (тироксинсвязывающий альфа-глобулин) и относительно инертный источник тиреоидных гормонов. Преальбумин и альбумин представляют собой как бы лабильную фракцию тиреоидных гормонов, способную поставить при различных стрессовых ситуациях необходимое количество свободных тиреоидных гормонов.
Способностью проникать в клетки, взаимодействовать со специфическими рецепторами и, в конце концов, оказывать биологические эффекты обладают лишь свободные формы тиреоидных гормонов (не связанные с белками плазмы). Доля свободных Т4 и ТЗ в составе общих тиреоидных гормонов очень мала (0,02-0,05 % от общего Т4 и 0,2-0,5 % по отношению к общему ТЗ). Связанные и свободные формы гормонов находятся в динамическом равновесии. Это означает, что любое уменьшение концентрации свободного гормона в крови автоматически приводит к увеличению отщепления его от белка-переносчика, и наоборот.
Одним из основных направлений метаболизма тиреоидных гормонов является дейодирование. Считается, что основным действующим гормоном является ТЗ, а тироксин является его предшественником — прогормоном, обеспечивающим постоянный запас гормона в малоактивной форме. Т4 связывается с рецепторами клеток-мишеней со сродством в 10 раз более слабым, чем ТЗ, т. е. преобладающей метаболически активной формой гормона действительно является ТЗ. В процессе монодейодирования Т4 конвертируется как в ТЗ, так и в обратный (реверсивный) трийодтиронин (рТЗ), являющийся биологически неактивным гормоном. В норме в течение суток щитовидная железа секретирует около 100 нмоль Т4; около 5 нмоль ТЗ и меньше чем 5 нмоль рТЗ.
Периферическое монодейодирование Т4 осуществляется с помощью ферментов-дейодаз (дейодиназ) и в настоящее время идентифицировано три типа таких дейодаз: тип I 5'-дейодаза; тип II 5'-дейодаза, тип III 5 '-дейодаза (Braverman, 1994; Hunt, 1984; Туракулов, Ташходжаева, 1986; Герасимов и др., 2002).
Тип I 5'-дейодаза наиболее широко представлена в тканях (печень, почки, скелетные мышцы и мышца сердца, щитовидная железа и др.). Она содержит селеноцистеин, и обеспечивает прохождение ТЗ в плазму. Тип II 5'-дейодаза представлена в ЦНС и гипофизе. Она поддерживает постоянную концентрацию внутриклеточного ТЗ, необходимого для нормального функционирования нервной и эндокринной систем, высоко чувствительна к циркулирующему уровню Т4. Между активностью фермента и содержанием Т4 имеется обратная зависимость, которая представляет собой «защитный» механизм нервной системы от избыточного образования ТЗ. В тех случаях, когда уровень Т4 повышается активность типа II 5'-дейодазы снижается. Тип III 5 '-дейодаза находится в плаценте и глиальных клетках нервной системы и может конвертировать Т4 в рТЗ (Ковальский, 1972; Dunn, Dunn, 2000; Zagrodzki et al, 2000).
При оценке содержания тиреоидных гормонов в крови следует учитывать влияние ряда экзогенных и эндогенных факторов на конверсию Т4 в ТЗ. Снижение конверсии Т4 в ТЗ наблюдается при низкокалорийной диете, заболеваниях печени, системных заболеваниях, недостаточности содержания в продуктах питания селена, а также при приеме пропилтиоурацила, анаприлина, глюкокортикоидов, амиодарона и различных рентгеноконтрастных веществ, содержащих йод (De Groot et al., 1996; Wiersinga, Krenning, 1998; Dunn, Dunn, 2000). Отщеплённый йодид образует в щитовидной железе пул, поддерживаемый поступающим в железу и отщепляемым йодидом, который далее используется для йодирования тирозина. В норме количество йодида, поступающего в щитовидную железу, соответствует количеству её покидающему. Тироксин (Т4), который синтезируется исключительно щитовидной железой, дейодируется также и в периферических тканях, главным образом в печени, почках, мышцах, гипофизе и др., в результате чего образуется ТЗ. В норме 80% ТЗ образуется именно на периферии из Т4 и только 20% продуцируется щитовидной железой. Процесс образования ТЗ очень важен для проявления биологического эффекта Т4.
Периферические ткани могут превращать Т4 не только в более активный ТЗ, но и в практически лишенный активности реверсивный ТЗ (рТЗ), в котором атом йода отсутствует во внутреннем кольце молекулы. В самой щитовидной железе образуется менее 3 % присутствующего в крови рТЗ ( 14-32 нг%, или около 0,3 нмоль/л); остальное его количество образуется вследствие периферической конверсии Т4 в тканях. Регуляторы переключения конверсии с биологически активного ТЗ на биологически неактивный рТЗ точно не известны, но основное значение имеет, по-видимому, обеспеченность организма энергией. При голодании, например, когда необходимо сохранять энергию, преобладает конверсия Т4 в рТЗ. На этот процесс влияют также многие гормоны и лекарственные вещества (Hunt, 1984; Josern et al, 1984; Bagchi et al., 1990).
Метаболизм Т4 осуществляется не только путем последовательного дейодирования, но и разрыва связей между двумя ароматическими кольцами с образованием ДИТ. Около 15-20 % тироксина инактивируется глюкуроновой и серной кислотами в печени с образованием глюкуронатов и сульфонатов, которые экскретируются с желчью. Лишь незначительная часть Т4 метаболизируется процессами дейодирования и сульфатирования в почках с последующей экскрецией метаболитов с мочой (Hunt, 1984; Nametz, 1984).
Другой путь катаболизма тиреоидных гормонов — дезаминирование и декарбоксилирование боковой аланиновой цепи с образованием три- и тетрайодтироуксусной кислот. Выделение йода из организма осуществляется преимущественно через почки (70-80 %). Период полувыведения Т4 составляет около 7 суток, ТЗ — около 1 суток (Hunt, 1984; Балаболкин, 1988).
Как уже упоминалось, щитовидная железа обильно снабжена афферентными и эфферентными нервами. Импульсы, приходящие к железе по симпатическим волокнам, стимулируют ее активность. Гормонообразование щитовидной железы находится под влиянием гипоталамо-гипофизарной системы. При снижении секреции йодсодержащих гормонов в плазме крови повышается содержание тиреотропного гормона (ТТГ) гипофиза. Этот гормон влияет на большинство этапов обмена йода. ТТГ, связываясь с рецепторами тиреоцитов, стимулирует накопление йодидов, органификацию, синтез тиреоидных гормонов, поступление йодированного тиреоглобулина из коллоида в цитоплазму тиреоцитов и высвобождение Т4 и ТЗ. Регуляция синтеза и секреции тиреоидных гормонов осуществляется по принципу отрицательной обратной связи: высокий уровень Т4 и ТЗ подавляет продукцию ТТГ, а низкий — стимулирует. Синтез и секреция ТТГ, в свою очередь, стимулируется тиреотропин-рилизинг-гормоном гипоталамуса (тиреолиберином). Секреция ТТГ тормозится не только ТЗ и Т4, но и гипоталамическими факторами — соматостатином и дофамином. Взаимодействие всех этих факторов и определяет весьма тонкую физиологическую регуляцию тиреоидной функции в соответствии с меняющимися потребностями организма (Туракулов, Ташходжаева, 1986; Tonacchera et al., 1996; Лавин, 1999).
Тиреоидные гормоны обладают широким спектром действия, но больше всего их влияние сказывается на клеточном ядре. Они могут непосредственно воздействовать и на процессы, протекающие в митохондриях, а также в клеточной мембране. У млекопитающих и человека тиреоиодные гормоны особенно важны для развития ЦНС и для роста организма в целом. Исследования показывают, что первой фазой гормонального действия является присоединение молекулы гормона к белку через амино- и карбоксильные группы аланинового остатка. Затем атом йода, находящийся в положении 5 внутреннего ароматического ядра, отдает один электрон и приобретает положительный заряд. Эта форма йода обладает максимальной биологической активностью. Отданный йодом электрон затрачивает часть своей энергии на синтез аденозинтрифосфорной кислоты из аденозинфосфата и фосфорной кислоты. Энергия электрона может акцептироваться также ди- и трифосфопиридиннуклеотидом. В конечном итоге энергия запасается в виде макроэнергетических связей.
Положительно заряженный атом йода захватывает электрон с низкой энергией из сопряженной окислительной цепи. При этом молекула гормона возвращается к своему исходному состоянию, в котором она снова может служить донором электрона, обладающего высокой энергией (Hunt, 1984; Марри и др., 1993; Кадырова и др., 1996).
В большинстве ферментных систем, осуществляющих запас энергии за счет окислительно-восстановительных процессов, необходимым условием функционирования является синхронный перенос электронов с молекулы донора на субстрат. Там, где требуется такой перенос электрона, тиреоидные гормоны становятся абсолютно незаменимыми. Кроме того, перенос электрона тиреоидными гормонами осуществляется на субмолекулярном уровне и каждая молекула гормона может обеспечить огромное количество биохимических превращений. В этом состоит уникальность действия тиреоидных гормонов и поэтому йод не может быть заменен никаким другим химическим элементом.
Являясь структурным компонентом ТГ, йод определяет активность течения практически всех метаболических процессов в организме. ТГ обладают широким спектром действия. Можно определить три главных направления действия гормонов:
1. Метаболическое — выражающееся в регуляции обменных процессов: увеличение синтеза белка, повышение распада жиров и углеводов, что происходит во всех клетках организма, особенно нервной системы.
2. Регуляторное — гормоны щитовидной железы регулируют энергетический обмен, обмен белков, жиров и углеводов, кальция во всех клетках организма, в том числе и нервной системе, регулируют уровень содержания сахара в крови. Гормоны щитовидной железы необходимы для контроля образования тепла, скорости поглощения кислорода клетками, участвуют в поддержании нормального функционирования дыхательного центра, иммунитета.
3. Адаптационное — наряду с гормонами коры надпочечников они обеспечивают физиологическую адаптацию, то есть способность организма приспосабливаться, изменять свою активность в зависимости от потребностей в ней конкретного органа или системы (Балаболкин, 1989; Марри и др., 1993; Braverman, 1994; Герасимов и др., 2002).
Известно стимулирующее действие тиреоидных гормонов на скорость потребления кислорода (калоригенный эффект) всем организмом, а также отдельными тканями и субклеточными фракциями. Тиреоидине гормоны в сочетании с адреналином и инсулином способны непосредственно повышать захват кальция клетками и увеличивать концентрацию в них циклической аденозинмонофосфорной кислоты, а также транспорт аминокислот и сахаров через клеточную мембрану (Марри и др., 1993; Флетчер и др., 1998; Wiersinga et al., 1998).
Особую роль играют тиреоидные гормоны в регуляции функции сердечно-сосудистой системы. Они влияют на состояние и качество работы сердечной и скелетных мышц, состояние жировой ткани, улучшают кроветворение, стимулируют моторику желудочно-кишечного тракта (Mussa et al., 1989; Глиноэр, 1997; Касаткина, 1997; Лавин, 1999;Щеплягина, 1999). Тахикардия при тиреотоксикозе и брадикардия при гипотиреозе характерные признаки нарушения тиреоидного статуса. Однако в настоящее время доказано, что избыточное содержание тиреоидных гормонов в организме приводит к снижению синтеза адреналина и норадреналина в надпочечниках и уменьшению концентрации катехоламинов в крови. При гипотиреозе концентрация катехоламинов возрастает (DeGroot et al, 1996; Кандрор, 2001).
Тиреоидные гормоны играют важную роль в жизнедеятельности человека любого возраста, но особенно в период внутриутробной и ранней постнатальной жизни. Наиболее важен в детском возрасте анаболический эффект ТГ. Они стимулируют образование энергии и повышают потребность тканей в кислороде, в физиологических дозах стимулируют синтез белка и способствуют процессам роста. ТГ повышают метаболизм углеводов, оказывают стимулирующее действие на ЦНС. В отличие от других анаболических гормонов ТГ не только и даже не столько контролируют линейный рост, сколько регулируют процессы дифференцирования тканей. Именно под влиянием ТГ дети не только растут, но и созревают, взрослеют.
Исключительно важное значение ТГ имеют для закладки и созревания мозга, формирования интеллекта ребенка. На ранних этапах внутриутробной жизни под влиянием ТГ закладываются и формируются основные церебральные функции. При дефиците ТГ мозг останавливается в развитии, подвергается дегенеративным изменениям, что резко ухудшает интеллектуальные и моторные функции человека. Но и после рождения ребенка значение ТГ в развитии его головного мозга и становлении познавательных функций имеет определяющее значение. В первые годы жизни ТГ отвечают за созревание высших структур головного мозга и интеллектуальный потенциал, физическое развитие и линейный рост, запуск и нормальное протекание полового созревания (Mussa et al., 1989; Bernal, Nunez, 1995; Pharaoah, Connolly, 1995;Глиноэр, 1997; Касаткина, 1997; Лавин, 1999; Щеплягина, 1999; Hetzel, 2000).
Щитовидная железа, несмотря на малые размеры и массу, за счет вырабатываемых гормонов влияет на организм по многим направлениям, обеспечивая нормальное функционирование большинства органов и систем. Причем это воздействие четко взаимосвязано с другими эндокринными железами-надпочечниками, половыми железами, гипофизом и др., нервной и иммунной системами. Это позволяет организму адекватно реагировать на постоянно изменяющиеся условия внешней и внутренней среды.
На протяжении всей жизни человека нормальный уровень тиреоидных гормонов является необходимым условием гармоничного функционирования организма. Сбой в работе щитовидной железы может привести к развитию как заболеваний самой щитовидной железы, так и дисфункции других органов. К основным дисфункциям щитовидной железы относятся гипер- и гипотиреоз.
Гипертиреоз (тиреотоксикоз) — синдром, обусловленный избыточным образованием тиреоидных гормонов и повышенным их уровнем в крови. Высокие дозы йода могут вызывать некроз гиперплазированных тиреоцитов у нормальных животных и тиреоидных фолликулов человека in vitro (Lima, Medeiros-Neto, 1984). Изучение эффектов антиоксидантов показало, что разрушение, вызванное йодом, опосредуется кислородными радикалами. Так, например, введение экзогенных антиоксидантов или дефицит внутриклеточных антиоксидантов могут ослаблять либо потенцировать эффекты йода(Bagchi et al., 1990). Основной обмен у больных бывает повышен до 150 %. Наблюдается усиление катаболизма белков, что ведёт к остеопорозу. Различные нарушения проявляются на уровне желудочно-кишечного тракта, печени и почек. Проявления гипертиреоза также включают различные многосистемные сдвиги, куда относятся нервозность, повышенная раздражительность, бессонница, слабость, потливость. При гипертиреозе наблюдается увеличение щитовидной железы, пучеглазие, тахикардия, частые головные боли, снижение умственной и физической работоспособности, головокружение, резкое повышение основного обмена и температуры тела, увеличении потребления пищи и, вместе с тем, потерей веса. Это заболевание называется Базедовой болезнью. Ее инициаторы - повышенное поступление йода в организм, стрессовые ситуации, психо-эмоциональные травмы, перенесенная инфекция (ангина, грипп, избыточное пребывание на солнце, беременность, климакс на фоне генетической предрасположенности) (Freire-Maia et al., 1982; Lima, Medeiros-Neto, 1984; Mussa et al., 1989; Флетчер и др., 1998).
Дефицит содержания свободных ТЗ и Т4 в сыворотке обуславливает появление клинического состояния, известного как гипотиреоз. Основным инициатором гипотиреоза является низкое поступление йода в организм. Постоянный недостаток йода приводит к нарушению функционирования тиреоидной системы, в первую очередь, к снижению синтеза и секреции основного гормона щитовидной железы Т4, что, по принципу обратной связи, стимулирует синтез и секрецию ТТГ гипофизом. Под его влиянием усиливается поглощение йодида щитовидной железой из циркулирующей крови, стимулируется синтез тиреоидных гормонов, причём синтезируется относительно большее количество ТЗ, для которого требуется меньше йода, чем для Т4, ускоряется кругооборот йода в щитовидной железе. Всё это — адаптационные механизмы экономии йода. Однако под влиянием ТТГ происходит пролиферация тиреоцитов — как гипертрофия (увеличение в размерах), так и гиперплазия (увеличение количества) фолликулярных клеток щитовидной железы, в результате чего железа увеличивается в размерах. Так формируется зоб — диффузный, узловой, диффузно-узловой, многоузловой. Детям и подросткам свойствен диффузный зоб, взрослым — узловые формы зоба. По сути, формирование зоба является компенсаторной реакцией, направленной на поддержание постоянного уровня тиреоидных гормонов в организме (Мохнач, 1974;De Groot et al., 1996; Балаболкин, 1998; Герасимов и др., 2002).
За последние годы появилась новая теория, в соответствии с которой снижение содержания йода в ткани щитовидной железы приводит к усиленной продукции местных тканевых факторов роста. К ним относятся: инсулиноподобный ростовой фактор 1-го типа, эпидермальный ростовой фактор, основной фактор фибробластов и трансформирующий ростовой фактор β, которые могут запускать пролиферативные процессы, ведущие к гиперплазии тиреоцитов. Вместе с этим было показано, что попадающий в щитовидную железу йод может взаимодействовать не только с белками, но и с липидами, в результате чего образуются йодлактоны. Последние являются мощными ингибиторами продукции выше упомянутых ростовых факторов. Кроме того, йодированные липиды предотвращают стимулирующие эффекты ТТГ в условиях достаточного внутритиреоидного содержания йода (Герасимов и др., 2002).
Нарушение функции тиреоидной системы приводит к целому ряду патологических состояний и заболеваний, которые принято объединять под термином «йоддефицитные заболевания».
Существует и другая сторона физиологической активности йода и некоторых его соединений. Имеются в виду токсические свойства положительно поляризованного одновалентного йода, в первую очередь, для бактерий, грибов и некоторых других микроорганизмов.
Различают четыре группы фарм препаратов йода: 1) содержащие элементарный йод (спиртовой раствор йода, раствор Люголя); 2) неорганические йодиды (калия и натрия йодид); 3) органические вещества, отщепляющие элементарный йод (йодоформ, йодинол и др.); 4) йодсодержащие органические вещества, в молекуле которых йод связан прочной связью (рентгеноконтрастные вещества). Препараты, содержащие йод, обладают различными свойствами. Элементарный йод оказывает противомикробное действие. Применение йода в качестве антисептика было начато великим русским хирургом Н.И. Пироговым еще в середине девятнадцатого века. Антимикробными свойствами обладают только соединения положительно поляризованного одновалентного йода, а именно, свободный молекулярный йод, однохлористый йод, а также его комплексные соединения с небелковыми полимерами. Молекулярный йод, как и все соединения положительно-поляризованного одновалентного йода, вызывают существенные необратимые изменения в клетках. Проникая сквозь клеточную мембрану, они вызывают повреждение митохондрий и окисление сульфгидрильных групп в молекулах ферментов, приводящее к их инактивации. Цитотоксическое действие этих соединений усиливается повреждением клеточных мембран из-за связывания йода их липидными и липопротеидными компонентами. Ведущим механизмом здесь, по-видимому, является электрофильное присоединение йода к кратным связям углерод-углерод в ненасыщенных фрагментах молекул липидов (Мойсель и др., 1971; Ковальский, 1972; Мохнач, 1974).
В парообразном состоянии молекулярный йод обладает резким запахом, пары йода оказывают сильное раздражающее действие на слизистые оболочки дыхательных путей, вызывая кашель, насморк, слезотечение, головокружение и др. При концентрации паров йода в помещении около 0,0015-0,002 мг/л работа затруднена, а при 0,003 мг/л — невозможна. Вдыхание паров более 18 мг/кг — смертельно. Предельная концентрация паров йода в воздухе рабочей зоны— 1 мг/м3. При приеме внутрь молекулярного йода в токсических количествах (2 — 3 г) быстро развиваются симптомы острого отравления, прежде всего со стороны желудочно-кишечного тракта вследствие прижигающего действия йода на слизистые оболочки. При попадании на кожу молекулярный йод может вызвать дерматиты. Токсичность соединений элементарного йода ограничивает его применение в качестве антибактериального, противогрибкового и антивирусного средства. Для этих целей значительно большее применение получили комплексные соединения йода с органическими полимерами (с крахмалом, амилазой, поливиниловым спиртом). Антибактериальная и противогрибковая активность йодполимерных комплексов оказалась в 2-8 раз выше, чем у растворов молекулярного йода, но вместе с этим, йодполимерные комплексы не оказывали, в отличие от молекулярного йода, прижигающего, раздражающего и токсического действия ни на отдельные ткани и органы, ни на организм животных и человека в целом (Мохнач, 1974).
Другие формы йода — йодиды и йодаты — являются нетоксичными и противомикробным действием не обладают. Йодиды, в отличие от молекулярного йода, не оказывают раздражающего действия на кожу и слизистые оболочки животных и человека, они не обладают антибактериальным, антивирусным и антитоксическим действием. Йодаты также не обладают ни токсичностью, ни противомикробным действием (Васюк и др., 1974; Мохнач, 1974).
Человек не является единственным видом, для которого йод является физиологически активным микроэлементом. В организме позвоночных животных йод выполняет те же функции, что и в организме человека. Животные, в том числе сельскохозяйственные, в той же мере чувствительны к недостатку йода, как и человек. При недостатке йода нарушается синтез тиреоидных гормонов, что приводит к снижению интенсивности окислительно-восстановительных процессов, нарушается белковый и углеводный обмен. Следствием этих нарушений является снижение рождаемости и качества потомства, продуктивности взрослых животных. С другой стороны, введение в организм животных йодированного корма (путем добавки в корма йодидов или их аэрозольное распыление) положительно влияет на привес растущего молодняка, улучшает общее состояние и товарные качества животных. Однако добавка в корм животных йодистых солей не всегда может оказаться эффективной, так как они усваиваются организмом животных на 10-33 %. Человек и животные лучше усваивают органически связанный йод, содержащийся в растительной пище, поэтому в целях большей обеспеченности рациона питания (кормов) йодом, перспективным является создание биотехнологий производства растительных продуктов с заданным содержанием в них йода (Школьник, 1974; Кашин, 1987; Оголева и др., 1987;).
До начала двадцатого века йод не считался необходимым элементом питания для растений, объяснялось это отсутствием его в составе ферментов и растительных гормонов. Кроме того, было обнаружено, что йод и его соединения при избыточной концентрации в питательной среде обладают значительной токсичностью по отношению к растениям, выращиваемым на этой среде.
В последнее время принято считать, что необходимыми являются микроэлементы, не только входящие в состав гормонов и ферментных комплексов, но и те, которые связаны с неспецифической активацией энзиматических систем, участвуют в метаболизме, входят в структурные компоненты клетки и др. Опыты с водорослями, томатами показывают, что необходимость йода проявляется прежде всего для тех видов, которые отличаются повышенным содержанием этого микроэлемента (Васюк и др., 1974). Показано, что йод в жизни растений оказывает влияние на азотный, углеводный, энергетический и водный обмены, на ферментативную активность и биосинтез пигментов, на рост и продуктивность растений. Это свидетельствует об эссенциальности йода для растений, что он тесно связан с обменом веществ и исключение его из питательной среды приводит к нарушению нормального хода физиологических процессов (Васюк и др., 1974; Школьник, 1974; Кашин, 1987).
Все вышесказанное представляет собой далеко не полное обобщение специфических физиологических функций йода, при этом следует отметить, что эти функции не могут взять на себя никакие другие химические элементы и соединения.
Литература:
Балаболкин М.И. 1988. Достижения в изучении биосинтеза тиреоидных гормонов//Проблемы эндокринологии. Т.34. № 2. С.46-50.
Балаболкин М.И. 1989. Эндокринология. Учебное пособие для субординаторов и интернов. М: Практика. С.131-196.
Васюк П.А., Жидков В.А., Ивченко В.И. 1974. Участие микроэлементов в обмене веществ растений //Биологическая роль микроэлементов. С.41-47.
Велданова М.В., Скальный А.В. 2001. Йод—знакомый и незнакомый. М. 112с.
Герасимов Г.А., Фадеев В.В., Свириденко Н.Ю., Мельниченко Г.А., Дедов И.И. 2002. Йоддефицитные заболевания в России. Простое решение сложной проблемы. М.: Адамантъ. 168 с.
Глиноэр Д. 1997. Функция щитовидной железы матери и новорожденного при легкой йодной недостаточности //Тироид Россия. Дармштадт. С. 19-26.
Кадырова Д.А., Атаханова Б.А., Туракулов Я.Х. 1996. Изучение полиморфизма генатиреоглобулина щитовидной железы человека // Проблемы эндокринологии. Т.42. № 5. С.34-37.
Кандрор В.И. 2001. Молекулярно-генетические аспекты тиреоидной патологии // Проблемы эндокринологии. Т.47. № 5. С.3-10.
Касаткина Э.П. 1997. Йоддефицитные заболевания у детей и подростков // Проблемы эндокринологии. Т.43. №З.С.З-7.
Кашин В.К. 1987. Биогеохимия, фитофизиология и агрохимия йода. Л.: Наука. 290 с.
Ковальский В.В. 1972. Биологическая роль йода. М.: Мир. 332с.
Лавин Н. 1999. Болезни щитовидной железы у детей // Эндокринология. /Под ред. Н. Лавина. М.: Практика. С.611-657.
Марри Р., Греннер Д.Б. Мейес П.. Родуелл В. 1993. Биохимия человека. / Под ред. Л.М. Гинодмана. М.: Мир. 414с.
Мойсель Н.М., Мохнач В.О., Вакина Н.П. 1971. О механизме антимикробного действия биологически активных форм йода // Изв. АН СССР. Сер. биол. № 6. С.819-829.
Мохнач В.О. 1974. Йод и проблемы жизни. Л.: Наука. 283с.
Оголева В.П., Бессережнова Н.К., Лушкин А.С., Ковалева Г.Т. 1987. Йод в животноводстве Нижнего Поволжья // Химия в сельском хозяйстве. № 2. С.30-33.
Панасин В.И., Рымаренко ДА., Дедков В.П., Саврасова Т.А. 2002. Содержание и распространение йода в экосистемах Калининградской области. Калининград: Изд-во КГУ. 116 с.
Туракулов Я.Х., Ташходжаева Т.П. 1986. Внутритиреоидное дейодирование тироксина: влияние ТТГ и денервации щитовидной железы // Проблемы эндокринологии. Т.32. № 5. С.72-76.
Флетчер Р., Флетчер С., Вагнер Э. 1998. Клиническая эпидемиология. /Пер. с англ. С.Е. Бащинского, С.Ю. Варшавского. М.: Медиа Сфера. 352 с.
Школьник М.Я. 1974. Микроэлементы в жизни растений. Л.: Наука. 330 с.
Щеплягина Л.А. 1999. Проблемы йодного дефицита // Русский медицинский журнал. № 11. С.523-527.
Bagchi N., Brown Т.R., Herdegen D.M., Dhar A. 1990. Antioxidants delay the onset of thyroiditis in Obese strain chickens//Endocrinol. Vol.127. P. 1590-1595.
Bernal J., Nunez J. 1995. Thyroid hormones and brain development//Eur. J. Endocrinol. Vol.l33.No.4. P.390-398.
Braverman L.E. 1994. Iodine and the thyroid: 33 years of study // Thyroid. Vol.4. P.351-356.
Buchinger W., Lorenz W.O., Semlitsch G., Langsteger W., Binter G., Bonelli R.M., Eber O. 1997. Thyrotropin and thyroglobulin as an index of optimal iodine intake: correlation with iodine excretion of 39,913 euthyroid patients //Thyroid. Vol.7. P.593-597.
Dai G., Levy O., Carrasco N. 1996. Cloning and characterization of the thyroid iodide transporter//Nature. Vol.379. No.6564. P.458-460.
DeGroot L.J.,Larsen P.R.,Hennemann G. 1996. The Thyroid and its Diseases. 6th ed. New York: Churchill Livingstone Inc. 793 p.
Dick M., Watson F. 1981. A possible variant of thyroxinebinding globulin in Australian Aboigines. // Clin. Chim. Acta. Vol.116. No.3. P.361-367.
Drexhage H. A. 1994. The spectrum of thyroid autoimmune diseases: pathogenetic mechanisms // Thyroid International. № 4. P. 16.
Dunn J.T., Dunn A.D. 2000. Thyroglobulin: chemistry, biosynthesis and proteolysis // Braverman L.E., Rutiger R.D. The Thyroid. A Fundamental and Clinical Text 8th ed. Philadelphia, PA: Lippincott Williams & Wilkins.
Freire-Maia A., Freire-Maia D.V., Morton N.E. 1982. Epidemiology and genetic of endemic goiter II. Genetic aspects //Human Heredity. Vol.32. No.3. P. 176-180.
Gaitan E. 1990. Goitrogens in food and water // Ann. Rev. Nutr. Vol.10. P.21-39.
Tonacchera M., Van Sande J., Parma J. 1996. TSH receptor and disease//Clin. Endocrinol. Vol,44. P.621-633.
Hetzel B.S. 2000. Iodine and neuropsychological development // J. Nutr. Vol. 130 (28 Suppl). P.493-495.
Hunt S. 1984. Halogenated Tyrosine Derivatives in Invertebrate Scleroproteins: Isolation and Identification // Methods in Enzimology. Vol.107. P.413-438.
Josern T.N., Morrison S., Farahe M. 1984. lodination by Thyroid Peroxidase// Methods in Enzimology. Vol.107. P.445-475.
Lima N., Medeiros-Neto G. 1984. Transient thyrotoxicosis in endemic goiter patients following exposure to a normal iodine intake // Clin. Endocrinol. Vol.21. No.6. P.631-637.
Mussa G.C., Zaffaroni M., Mussa F. 1989. Thyroid and growth: thyroid hormones and development of the nervous system // J. Endocrinol. Invest. Vol.12 (Suppi 3). P.85-94.
Nametz J. 1984. lodination by Thyroid Peroxidase//Methods in Enzimology. Vol.107. P.30-42.
Pharaoah P., Connolly K.. 1995. Iodine and brain development // Developmental Medicine and Child Neurology. Vol.38. P.464-469.
Sugawara M., Summer C.N., Kobayashi A., Murakami S., Kuma K., Medeiros-Neto G.A. 1990. Thyroid peroxidase in endemic goiter tissue // J. Endocrinol. Invest. Vol.13. No.ll.P.893-899.
Suzuki M., Tamura T. 1985. Iodine intake of Japanese male university students: urinary iodine excretion of sedentary and physically active students and sweat iodine excretion during exercise // J. Nutr. Vitaminol. (Tokyo). Vol.31. No.4. P.409-415.
Volpe R. 1989. Autoimmune thyroiditis // Thyroid function and disease. / Eds. Burrow G.N., Oppenheimer J.H., Volpe R. Philadelphia: W.B. Sounders Company. P. 191-207.
Wiersinga W.M., Krenning E.P. 1998. Schildklierziekten [Diseases of the thyroid]. 2nd ed. Bohn Stafleu van Loghum Houten, The Netherlands.
Zagrodzki P., Szmigiel H., Ratajczak R., Szybinski Z., Zachwieja Z. 2000. The role of selenium in iodine metabolism in children with goiter//Environ. Health Perspect. Vol. 108. P.67-71.
 Обратная связь
Обратная связь