
 bioiod@bioiod.ru
bioiod@bioiod.ru Обратная связь
Обратная связь1ГУ НИИ Питания РАМН, Устьинский пр., д. 2/14, Москва, 109240, Россия.
2ООО «НПФ Техновита», ул. Ленина, 73, Боровск, Калужская обл., 249010, Россия.
1Institute of Nutrition RAMS, Ust, insky Proezd Str. 2/14, Moscow, 109240, Russia.
2OOO «SPF Technovita», Lenina Str. 73, Borovsk, Kaluga Region, 249010, Russia.
Йод относится к числу незаменимых микроэлементов, необходимых для нормального роста и развития человека. Суточная потребность в нем составляет 100-200 мкг. Недостаточное потребление йода приводит к йоддефицитным заболеваниям (ЙДЗ), которые обусловлены нарушением синтеза тиреоидных гормонов — регуляторов практически всех биохимических процессов в организме. По данным ВОЗ, около 2 млрд жителей Земли существуют в условиях йодного дефицита (ЙД) | 29, 30]. Исследования, проведенные Эндокринологическим научным центром РАМН, показали, что в последние годы у жителей практически всех территорий России обнаруживается та или иная степень йодного дефицита. Потребление йода при этом составляет 40-80 мкг/сут, что в 2-3 раза меньше необходимого [9, 23].
Общепризнанно, что ЙДЗ могут быть предотвращены при нормализации потребления йода, который поступает в организм человека в основном с пищей [6, 7] - как в виде неорганических соединений (йодаты и йодиды), так и в органической форме (йодированные аминокислоты и белки) [ 11, 24].
Для ликвидации йодной недостаточности существует два подхода: йодирование пищевой поваренной соли путем внесения в нее йодидов или йодатов калия [2, 5, 9], а также использование в рационе питания йодированных белков молока как наиболее близких к веществам природного происхождения по структуре и свойствам (11, 24 ]. С этой целью в ООО «НПФ Техновита» разработана приоритетная технология производства йодированных белков молока [10,12-14].
Материал и методы
В качестве объектов исследования использованы: опытный образец — йодированный белок молока «Биойод» (ООО «НПФ Техновита») [10] и исходный нейодированный молочный белок (контрольный образец).
Йодированные производные: MIT - монойод-тирозин, DIT - дийод-тирозин, LevTyr - левотироксин получены от фирмы «Sigma Chemical С°» (США), фермент проназа (pronase type XIV) - от фирмы «DakoCytomation» (Дания); остальные химикаты и реагенты - «аналитически чистые». Инкубацию белков с проназой при 37° С проводили на термостате 5320 («Eppendorf», Германия). Хроматографическое разделение белков осуществляли на приборе Breeze («Waters», США). Для разделения йодированных аминокислот использовали колонку Jupiter C18 («Phenomenex», США), для разделения белков — колонки Superdex 70 («Amersham Biosciences») и Delta-pak C4 («Waters»). Для лиофилизации исследуемых образцов использовали лиофильную сушилку Alpha 2-4 («Christ», Германия).
Гидролиз белков. Для проведения гидролиза белки растворяли в 0,1 М Трис-HCl буфере (рН 8,0) до концентрации 2 мг/мл, добавляли проназу в количестве 1/10 от массы белка и инкубировали 16ч при 37° С. Гидролизат центрифугировали 15 мин при 10 000 об/мин для осаждения нерастворимых продуктов и анализировали методом высокоэффективной жидкостной хроматографии (ВЭЖХ).
Разделение йодированных аминокислот. Смеси, полученные в результате гидролиза, разделяли на колонке Jupiter С18. Разделение проводили в градиенте концентрации ацетонитрила [19] в воде, в присутствии 1% уксусной кислоты. Детектирование осуществляли при длинах волн 254 и 280 нм.
Разделение белков. Разделение белков проводили в 2 стадии. Сначала их подвергали гель-фильтрации на колонке Superdex 70, уравновешенной 50 мМ Трис-НСI (рН 7,5), содержащим 0,1 М KCl и 10 мМ ЕДТА. Полученные фракции лиофилизовали и подвергали дальнейшему фракционированию на колонке Delta-pack С4 в градиенте концентрации ацетонитрила в воде (в присутствии 0,1% трифторуксусной кислоты) от 35 до 50% за 60 мин. Для дальнейшего исследования полученные белковые фракции лиофилизовали и проводили MALDI (matrix assisted laser desorption ionization) масс-спектрометрию. Съемку масс-спектров осуществляли на масс-спектрометре REFLEX III («Bruker Daltonics», Германия). В качестве матрицы использовали 2,5-диоксибензойную кислоту. Регистрировали положительные ионы с использованием линейного анализатора. В качестве внешнего стандарта служил лизоцим яичного белка (14308 Да).
Определение йода. Идентификацию и количественное определение йода в исследуемых образцах молока проводили путем разложения органического вещества при сжигании пробы в электропечи в условиях контролируемой температуры и последующего определения йода (в форме йодида) методом инверсионно-катодной переменнотоковой вольтамперометрии в среде инертного газа при рН 2 по высоте пика электрохимического восстановления с максимумом от -190 до -280 мВ ртутно-йодидной соли в результате ее предварительного электронакопления на поверхности ртутного электрода при постоянном потенциале +10 мВ. Использовали метод внутреннего стандарта в соответствии с МУК 4.1.1187 - 03 [1].
Для анализа йода использовали вольтамперометрический анализатор - полярограф ABC - 1.1 в комплекте с IВМ - РС - совместимым компьютером («Вольта», Санкт-Петербург), а также полупроводниковый гамма - спектрометр LP 4900В, рентгеновский анализатор SBS - 50M («Грин-Стар», Россия) и иономер И -120.1. («НПФ Эконикс», Россия). Ионометрическое определение йода проводили на указанном иономере с применением йодидселективного электрода в буферной системе в соответствии с АОАС Official Method 992.24 [18]. При нейтронно-активационном анализе йода исследуемые образцы (масса 2 - 3 мг) запаивали в полиэтиленовые пакетики, помещали вместе с эталонами йода (10-5 г) в полиэтиленовые ампулы и облучали в горизонтальном канале реактора 30 с, затем измеряли гамма-спектры облученных образцов на полупроводниковом гамма-спектрометре LP 4900B. Количество йода в образце определяли в сравнении с интенсивностью сигналов эталонов. Рентгенорадиометрическпй анализ проведен на рентгеновском анализаторе SBS-50M так же, как и при нейтронно-активационном методе анализа (без предварительной пробоподготовки) путем сравнения с контрольной пробой - эталоном.
Результаты и обсуждение
Результаты содержания йода в йодированном белке «Биойод», полученные разными методами, приведены в таблице.
Йодированные белки в небольших концентрациях присутствуют в обычных пищевых продуктах (молоке и молочных продуктах, рыбе и рыбопродуктах и др.) [24]. Существуют различные способы искусственного получения йодированных белков - химические и ферментативные, при которых происходит в основном замещение водорода в фенольном кольце тирозина на йод с образованием моно- и(или) дийодтпрозиновых производных белков [15, 20, 22].
ООО «НПФ Техновита» разработан промышленный способ получения йодированных белков молока с использованием в качестве йодирующего компонента неорганического йода (йодид, молекулярный йод) и смеси ферментов (лактатпероксидазы, каталазы и др.), иммобилизованных на полупроницаемых мембранах и (или) инертных носителях. После окончания процесса проводится макро- и микрофильтрация с последующей диафильтрацией. Окончательной стадией получения йодированных белков молока явилась очистка их на сефадексе G25 методом эксклюзионной гель-фильтрации, позволяющим полностью отделить высокомолекулярные белковые фракции от низкомолекулярных соединений и особенно от исходных, не связанных с белком йодирующих компонентов (йода и йодидов). В результате гель-фильтрации выделены фракции с молекулярной массой, превышающей 14 кДа. Затем раствор йодированного белка, очищенный от низкомолекулярных фракций, подвергали стерилизующей микрофильтрации и сублимационной сушке (10).
Содержание йода в йодированных молочных белках при исследовании различными методами
|
Используемый метод |
Результат, % |
|
Вольтамперометрический Нейтронно-активационный Рентгенорадиометрический Ионометрический |
2,20 2,50 2,45 2,05 |
Задачей настоящего исследования было изучение структуры и физико-химических свойств йодированных белков, полученных указанным способом (подтверждение наличия в препарате «Биойод» йодированных белков; определение места включения в белок йода и степени йодирования белка).
Такие физико-химические методы, как ЯМР-, ИК-спектроскопия и УФ-спектроскопия, мы не использовали в связи с их низкой информативностью при определении наличия йода в белках. Наиболее информативна для этих целей MALDI масс-спектрометрия, позволяющая с высокой точностью определять молекулярную массу белков в широком диапазоне (до нескольких сотен кДа) [3, 27]. Разница в массе исходных и йодированных белков позволяет легко вычислить количество включенных в белок атомов йода. Для доказательства наличия йодированных белков в опытном образце молока последний подвергали фракционированию методами гель-фильтрации и обращенно-фазной хроматографии.
На рис. 1 представлен профиль разделения смеси нейодированных и йодированных молочных белков. Видно, что в состав последних входят белки с молекулярной массой >70 кДа (пик с максимумом поглощения при 15 мин), около 20 кДа (фракция А, максимум поглощения при 22 мин) и около 15 кДа (фракция В, максимум поглощения около 26 мин).
Основываясь на имеющихся данных о белковом составе молока и молекулярных массах составляющих молочных белков [4, 8], можно заключить, что фракция А содержит (β-лактоглобулин с молекулярной массой 18 кДа, а фракция В — α-лактальбумин с молекулярной массой 14 кДа. Эти белки, как нейодированные, так и йодированные, могут быть достаточно легко идентифицированы с помощью MALDI масс-спектрометрии. Фракции А и В йодированных и нейодированных образцов молока, содержащие белки
| Рис. 1. Разделение йодированных (сплошная линия) и нейодированных молочных белков (пунктир) методом гель-фильтрации на колонке с Супердексом 70. Стрелки указывают место выхода белков, использованных для калибровки колонки (бычий сывороточный альбумин - 67 кДа и цитохром С - 13 кДа). Фракции А и В использованы для дальнейшего разделения. По оси абсцисс - время, мин (здесь и на рис. 2,4, 5). | 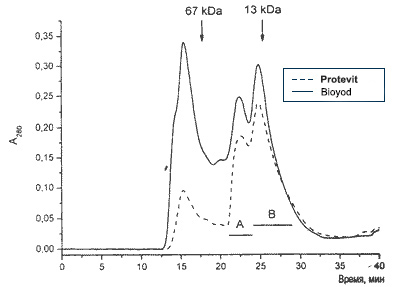 |
|
Рис. 2. Разделение фракций, полученных в результате гель-фильтрации йодированных и нейодированных белков (см. рис. 1), методом обращенно-фазной хроматографии. Отмечена фракция (MS), исследованная методом MALDI масс-спектрометрии. Сплошная линия-фракция В йодированных белков, пунктир - фракция В нейодированных белков, пунктир с точкой-фракция А нейодированных белков. |
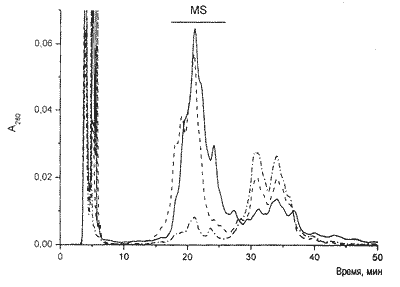 |
с молекулярной массой, соответственно, около 20 и 15 кДа подвергали разделению методом обращенно-фазной хроматографии на колонке Delta-pak С4. Профиль разделения представлен на рис. 2. Как видно, во фракции В доминирует пик, элюирующийся между 15 и 25 мин, а во фракции А — пик, элюирующийся между 30 и 40 мин. Для дальнейшего анализа нами использована более гомогенная и более интенсивная фракция, элюирующаяся между 15 и 25 мин. Эту фракцию, отмеченную на рис. 2, собирали, лиофилизовали и анализировали методом MALDI масс-спектрометрии (рис. 3). Спектр нейодированного белка характеризуется наличием доминирующего сигнала, соответствующего белку с молекулярной массой 14 174 Да. Этот белок, очевидно, является α-лактальбумином, расчетная масса которого составляет 14 178 Да. В спектре присутствуют также менее интенсивные сигналы, соответствующие, по-видимому, другим вариантам α-лактальбумина. Йодирование белков молока приводит к существенному изменению масс-спектра полученного белка. Практически полностью отсутствует сигнал, относящийся к немодифицированному α-лактальбумину. При этом появляются сигналы 14340, 14466 и 14595 Да, соответствующие белкам, содержащим соответственно 1, 2 и 3 атома йода в молекуле. Хотя метод масс-спектрометрии не является количественным, тем не менее, основываясь на относительной интенсивности сигналов, можно предположить, что основным продуктом йодирования является белок, в молекуле которого содержится 2 атома йода.
Результаты исследования йодированного образца молока методом масс-спектрометрии свидетельствуют о том, что в его состав входят йодированные белки. Полученные данные позволяют сделать вывод, что в опытном образце молока представлены белки, содержащие от 1 до 3 атомов йода на 1 моль белка. Исходя из этих результатов, расчетный уровень йода в йодированном белке, содержащем 1 атом йода, составляет 0,88%, 2 атома йода - 1,74%, 3 атома йода - 2,59%.
Однако метод масс-спектрометрии позволяет лишь определить общее количество включенных атомов йода и не дает ответа на вопрос, в какие аминокислотные остатки он включился. Следующей задачей исследования было установить наличие в смеси йодированных молочных белков йодированных остатков тирозина [ 15,20,22].
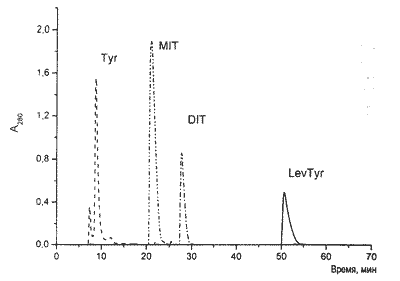
Для определения йодированных аминокислотных остатков в белках существует целый ряд методов, основанных на различиях в свойствах немодифицйрованных и йодированных аминокислот. В частности, некоторые методы основаны на различиях в поведении аминокислот при хроматографии [17,19,21,25,26, 31]. Для воспроизведения методики разделения мы подвергали хроматографии нейодированный тирозин, дийод-тирозин, тироксин, а также смесь, полученную в результате йодирования тирозина хлораминовым методом (рис. 4). Полученные результаты показывают, что йодированные тирозины могут быть надежно обнаружены с использованием обращенно-фазной хроматографии.
Однако для использования этих методов необходимо получить аминокислоты в свободном состоянии. Поскольку йодированные аминокислоты, в частности йодтирозины, неустойчивы в условиях кислотного гидролиза, наиболее часто применяемого для расщепления белков до индивидуальных аминокислот, необходимо использовать иные методы гидролиза. Наиболее мягким и удобным для этой цели является ферментативный гидролиз [16, 17, 19, 26, 28]. Поэтому для гидролиза йодированного образца молока мы использовали фермент проназу. Параллельно проводили гидролиз нейодированного препарата.
Полученный гидролизат разделяли методом обращенно-фазной ВЭЖХ в соответствии с разработанной ранее методикой [19]. Детектирование элюата осуществляли в УФ-области при 2 длинах волн: 254 и 280 нм.
На рис. 5 приведены профили разделения смесей, полученных в результате гидролиза йодированных и нейодированной молочных белков. Как видно, в гидролизатах йодированных белков присутствуют пики, соответствующие DIT, который отсутствует в нейодированном образце. Использованные условия разделения не позволили строго определить наличие MIT (он элюируется совместно с триптофаном).
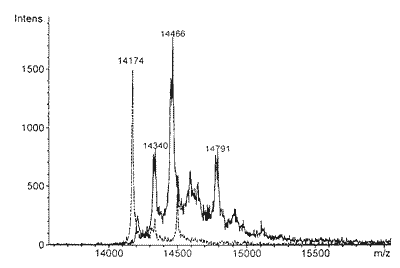 |
Рис. 3. MALDI масс-спектры фракций, полуденных в результате обращенно-фазной хроматографии (см. рис. 2) йодированного (сплошная линия) и нейодированного (пунктир) белка. |
|
Рис. 4. Разделение йодированных аминокислот методом обращенно-фазной хроматографии. Туг - тирозин, MIT - монойод-тирозин, DIT - дийод-тирозин, LevTyr - левотироксин (здесь и на рис. 5). |
 |
|
Рис. 5. Разделение продуктов гидролиза проназой йодированного белка. Пунктирные линии - гидролизаты нейодированно¬го белка. |
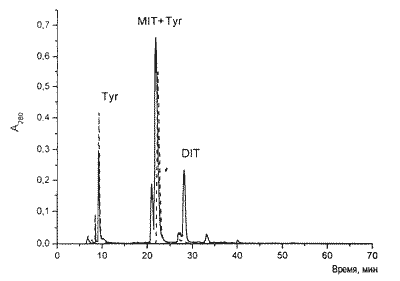 |
Однако наличие DIT, появляющегося в результате йодирования MIT и немодифицированного тирозина, свидетельствует о присутствии в препарате MIT.
Таким образом, опытный йодированный образец молока содержит йодированные остатки тирозина в виде МIТ и DIT, отсутствующие в контрольных (нейодированных) препаратах, при этом йодированные остатки тирозина входят в состав молочных белков, в частности α-лактоальбумина.
Для установления степени йодирования молочных белков йодированный образец молока был подвергнут межлабораторному исследованию с участком аккредитованных испытательных центров; определяли содержание в нем органически связанного йода (см. таблицу).
Практически совпадающие данные межлабораторной апробации, представленные в таблице, свидетельствуют о наличии в йодированном образце молока, ковалентно связанного с молочным белком йода в количестве от 2,05 до 2,50%. Это совпадает с расчетной концентрацией йода в йодированном белке (0,88-2,59%), полученной при масс-спектрометрическом исследовании.
Из имеющиеся данных об аминокислотном составе белков молока [4, 8] следует, что количество тирозиновых остатков, входящих в отдельные белки молока составляет: для α-казеина - 10, (β-казеина - 4, κ-казеина - 9, (β-лактоглобулина - 4, α-лактоальбумина - 4 аминокислотных остатка и т.д. Однако полученные в настоящем исследовании данные о включении йода в молекулы молочных белков (от 1 до 3 атомов йода в одну молекулу белка) свидетельствуют о частичном йодировании остатков тирозина, что можно объяснить стерическими препятствиями для включения йода в белок и микроокружением остатков тирозина в молекуле белка.
Авторы выражают благодарность доктору хим. наук Ю.Н. Уткину (Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН) за помощь и ценные советы при выполнении и оформлении работы.
Литература:
 Обратная связь
Обратная связь